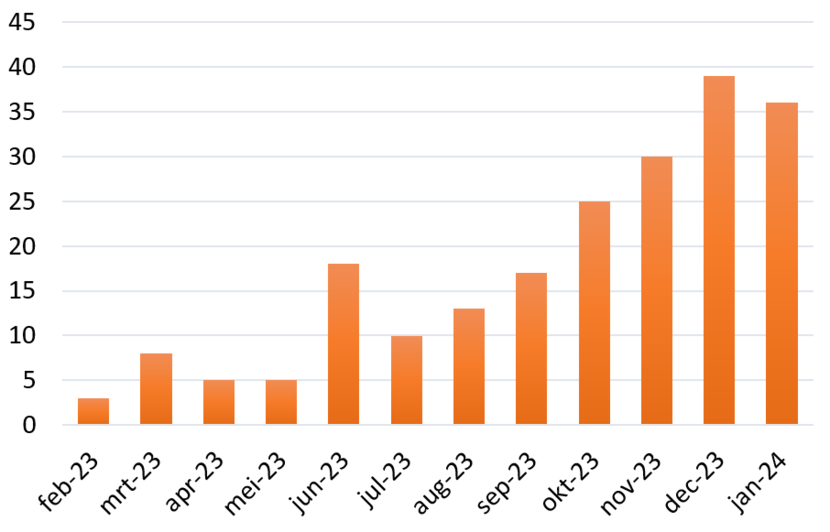
Aantal transitiestudies ingediend in Nederland t/m 31 januari 2024

Sinds 31 januari 2023 worden alle nieuwe aanvragen voor geneesmiddelenonderzoek via CTIS ingediend. Wat is de tussenstand? In deze nieuwsbrief ligt de focus op: transitiestudies, veiligheid en ATMP’s.

Op uiterlijk 30 januari 2025 moeten alle nog lopende geneesmiddelenstudies die onder de CTD zijn goedgekeurd overgezet zijn naar CTIS. Dit zijn zogeheten ‘transitiestudies’. De EMA heeft een grove inschatting gemaakt van het aantal te verwachten transitiestudies per lidstaat. Voor Nederland ligt dit rond de 1.390 studies. Precies één jaar voor de deadline is slechts een klein deel hiervan overgezet naar CTIS: 209 studies. Geen tijd te verliezen dus!
Het is van belang dat een transitiestudie op tijd wordt ingediend in CTIS. Er is in een versnelde administratieve procedure voorzien tot 16 oktober 2024. Deze procedure kan tot 22 dagen duren als er geen validatievragen (‘request for information’, RFI) zijn, of tot 37 dagen voor onderzoeksdossiers met validatievragen. In principe wordt een geneesmiddelonderzoek in transitie niet opnieuw beoordeeld. In uitzonderlijke gevallen is het mogelijk dat er een vragenronde (RFI) tijdens de beoordelingsfase plaatsvindt. In dat geval vervalt de versnelde procedure en gelden de standaard CTR-termijnen (maximaal 106 dagen). Tijdens de transitie mag het onderzoek gewoon doorgaan onder de CTD.

Op CCMO.nl is informatie voor opdrachtgevers gepubliceerd over transitiestudies, waarbij antwoord wordt gegeven op de volgende drie vragen:
Bekijk ook de tips onderaan deze nieuwsbrief, onder ‘Blijf op de hoogte’, voor onder meer webinars en video’s over transitiestudies.
De opdrachtgever van klinisch onderzoek meldt ‘suspected unexpected serious adverse reactions’ (SUSARs) in Eudravigilance. De jaarlijkse veiligheidsrapportage (annual safety report, ASR) wordt ingediend in CTIS. Het is niet meer nodig om veiligheidsrapportages daarnaast ook nog per e-mail in te dienen bij de Toetsende Commissie. Ook de verplichting om halfjaarlijkse SUSAR-overzichtslijsten in te dienen is vervallen. Voor transitiestudies gelden deze eisen vanaf het moment dat de studie in één van de EU-lidstaten is goedgekeurd.
De RSI wordt gebruikt om te bepalen welke ‘serious adverse reactions’ (SARs) als verwacht worden beschouwd en dus niet als ’suspected unexpected serious adverse reaction’ (SUSAR) in Eudravigilance worden gemeld. De RSI van een niet-geregistreerd onderzoeksproduct is een aparte sectie in de ’investigators brochure’ (IB). Het is niet hetzelfde als de informatie voor de onderzoeker, maar mag wel in deze sectie worden opgenomen. Het CTR Q&A document van de Europese Commissie beschrijft in detail hoe de RSI eruit moet zien, wanneer ‘suspected SARs’ mogen worden opgenomen en hoe de RSI-sectie eruit moet zien wanneer er geen ‘expected SARs’ zijn. Voor een geregistreerd onderzoeksproduct dat gebruikt wordt in een goedgekeurde indicatie, mag sectie 4.8 uit de ‘samenvatting van de productkenmerken’ (summary of product characteristics, SmPC) als RSI worden gebruikt. Voor meer informatie, zie vraag 7.7 tot en met 7.20 uit de CTR Q&A van de Europese Commissie.
Soms mag een ‘advanced therapy medicinal product’ (ATMP), dat niet voldoet aan de vastgestelde kwaliteitseisen, toch worden toegediend aan een onderzoeksdeelnemer. Een voorbeeld hiervan is een celtherapieproduct dat minder cellen bevat dan gewenst. In zo’n geval is sprake van een ‘out of specification’ (OOS) ATMP. De toediening van een OOS ATMP wordt gezien als een ’unexpected event’ (CTR, artikel 53). Voor ongeregistreerde middelen dient binnen 15 dagen na toediening melding te worden gemaakt in CTIS. Voor geregistreerde producten volstaat een periodieke melding. Als de melding in CTIS leidt tot deblindering, dan zullen de betrokken lidstaten buiten CTIS om moeten worden geïnformeerd. Zie voor meer informatie de CTR Quick Guide for Sponsors.
Deze nieuwsbrief is een uitgave van de Centrale Commissie Mensgebonden Onderzoek (CCMO).
E ccmo@ccmo.nl
T 070 340 6700