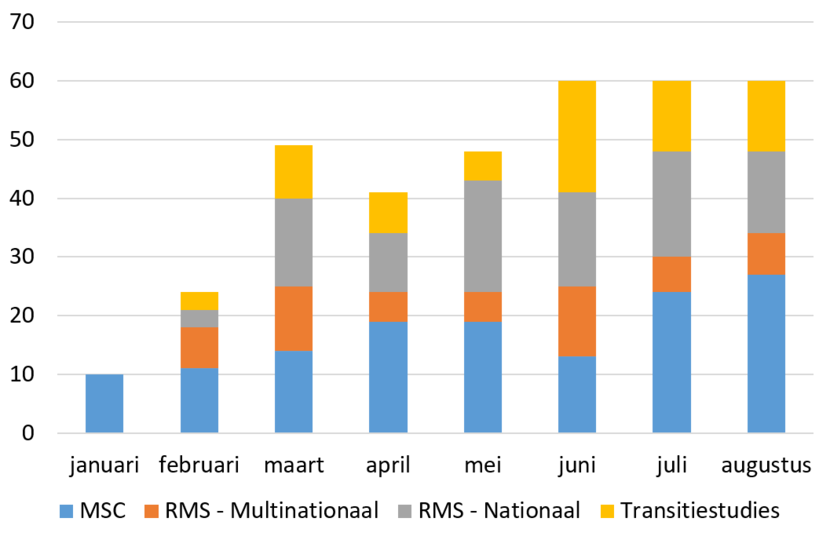
Aantal CTR-studies ingediend in Nederland: januari t/m augustus 2023*
- MSC (Member State Concerned): 137
- RMS (Reporting Member State) Multinationaal: 53
- RMS Nationaal: 95
- Transitiestudies: 67
*Incl. herindieningen.

Sinds 31 januari 2023 worden alle nieuwe aanvragen voor geneesmiddelenonderzoek via CTIS ingediend. Wat is de tussenstand? Met deze nieuwe serie nieuwsbrieven brengen wij jullie op de hoogte van de laatste ontwikkelingen.
*Incl. herindieningen.

In drie situaties dient een "Summary of Product Characteristics" (SmPC) te worden aangeleverd. Afhankelijk van de situatie is er naast de SmPC ook aanvullende informatie nodig.
Wanneer het "Investigational Medicinal Product" (IMP) geregistreerd is in de EU en er gebruik wordt gemaakt van commerciële batches, dan hoeft alleen de SmPC te worden aangeleverd.
Wanneer het IMP geregistreerd is in de EU en er gebruik wordt gemaakt van klinische batches, dan dient de SmPC te worden aangeleverd met daarnaast een samenvattende tabel waarin de verschillen tussen de klinische en de commerciële batches beschreven staan. Dit kan door middel van het aanleveren van een samenvatting van de wijzigingen (SoC) of een vereenvoudigd IMPD (sIMPD). Daarnaast moet men in de aanbiedingsbrief verantwoorden waarom er gebruik wordt gemaakt van klinische batches.
Wanneer het IMP geregistreerd is in de EU en gemodificeerd wordt (inclusief herverpakking en herlabelling), dan dient, naast de SmPC, een sIMPD te worden aangeleverd. In CTR Annex I (onder punt 52, tabel 1: ‘Content of the simplified IMPD’) staat voor verschillende situaties beschreven welke informatie de sIMPD moet bevatten.
Bij het uploaden van een aangepaste versie van een document in CTIS, dient ook een versie te worden meegestuurd waarin de wijzigingen zijn gemarkeerd (track changes). Dit geldt bijvoorbeeld bij de reactie op een verzoek om informatie (RFI), bij de indiening van een substantiële wijziging (SM) en bij de herindiening van een onderzoek.
Voor het protocol, de "Investigator’s Brochure" (IB) en het "Investigational Medicinal Product Dossier" (IMPD) dient daarnaast ook een samenvatting van de wijzigingen (SoC) te worden ingediend. Dit kan een los document zijn of het kan worden opgenomen in het gewijzigde document.
De opdrachtgever van een onderzoek is verantwoordelijk voor het melden van "Suspected Unexpected Serious Adverse Reactions" (SUSAR’s) in Eudravigilance. Indien de opdrachtgever de middelen hier niet voor heeft bestaat momenteel de mogelijkheid vrijstelling voor deze verplichting aan te vragen bij de CCMO. De CCMO zal aan het einde van de transitieperiode stoppen met deze dienstverlening. Dat betekent dat vanaf 30 januari 2025 geen vrijstelling meer kan worden aangevraagd en dat verleende vrijstellingen aflopen.
Georganiseerd door de EMA:
Gepubliceerd door de HMA:
Gepubliceerd door de IGJ:
Deze nieuwsbrief is een uitgave van de Centrale Commissie Mensgebonden Onderzoek (CCMO).
E ccmo@ccmo.nl
T 070 340 6700